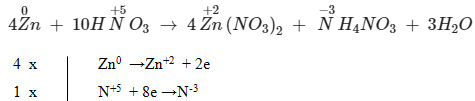Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Zn + HNO33 → Zn(KHÔNG3)2 + NHỎ4KHÔNG3 + BẠN BÈ2O được thuthuatcaidat.com biên soạn nhằm hướng dẫn học sinh viết và cân bằng phản ứng Zn tác dụng với HNO.3 Pha loãng sản phẩm để thu được muối NHỎ4KHÔNG3. Hi vọng với phần hướng dẫn chi tiết các bước cân bằng trên, các em sẽ biết cách vận dụng làm các dạng bài tập tương tự. Xin vui lòng tham khảo.
1. Phương trình phản ứng Zn tác dụng với HNO3
4Zn + 10HNO3 → 4Zn(KHÔNG3)2 + NHỎ4KHÔNG3 + 3 GIỜ2Ô
2. Hướng dẫn chi tiết cân bằng phản ứng Zn và HNO3
4Zn + 10HNO3 → 4Zn(KHÔNG3)2 + NHỎ4KHÔNG3 + 3 GIỜ2Ô
3. Điều kiện phản ứng giữa Zn và HNO3
nhiệt độ bình thường
4. Phương trình ion thu gọn Zn + HNO3
Phương trình phân tử của phản ứng Zn tác dụng với HNO3
4Zn + 10HNO3 → 4Zn(KHÔNG3)2 + NHỎ4KHÔNG3 + 3 GIỜ2Ô
Phương trình ion thu gọn:
4Zn + 10H+ + KHÔNG3– → 4Zn2+ + NHỎ4+ + 3 GIỜ2Ô
5. Bài tập liên quan
Câu hỏi 1. Cho hỗn hợp AlCl3 và ZnCl2 phản ứng với SOLUTIONS3 dư thu được kết tủa X. Lọc lấy X rồi nung nóng thu được chất rắn Y. Cho H . khí ga2 dư đi qua Y và nung nóng thu được chất rắn gồm
A. Al và Zn
B. Al2Ô3
C. Al và ZnO
D. Al2Ô3 và Zn
AlCl3 + 3NHS3 + 6 NHÀ2O → Al(OH)3 + 3NHS4Cl
ZnCl2 + 2NHS3 + 2 CĂN NHÀ2O → Zn(OH)2 + 2NHS4Cl
Zn(OH)2+ NHỎ3 còn lại → [Zn(NH3)6](Ồ)2
Câu 2. Cho phương trình hóa học: Zn + HNO3 → Zn(KHÔNG3)2 + NHỎ4KHÔNG3 + BẠN BÈ2Ô
Tổng các hệ số của phương trình là
A.22.
B.24.
C.25.
D.26.
4Zn + 10HNO3→ 4Zn(KHÔNG3)2+ NHỎ4KHÔNG3 + 3 GIỜ2Ô
Tổng các hệ số của phương trình là 22.
Câu 3. Hòa tan hoàn toàn hỗn hợp X gồm Zn và ZnO trong dung dịch HNO . giải pháp3 loãng dư không thấy khí thoát ra và dung dịch chứa 113,4 gam Zn(NO3)2 và 8g NHỎ4KHÔNG3. Phần trăm khối lượng của Zn trong X là
A. 33,33%
B.66,67%
C. 61,61%
D. 50,00%
ZnO phản ứng với HNO3 Không có sản phẩm khử nào được tạo ra vì số oxi hóa đạt cực đại
Bảo mật điện tử: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol
%mZn = (0,4,65)/(0,4,65 + 0,2,81).100%=61,61%
Đáp án nên chọn là:
Câu 4. Hòa tan hoàn toàn 13,00 gam Zn trong HNO . giải pháp3 Pha loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (dktc). Làm bay hơi dung dịch X thu được 39,8 gam chất rắn. Khí X là:
MỘT. KHÔNG2
B. NỮ2
CN2Ô
D. KHÔNG
Chúng tôi thiên đườngZn(NO3)2 = nZn = 0,2 mol
Giả sử một phân tử khí trao đổi n electron.
BT electron: ntôi chọn = ne nhận được => 2nZn = 8nNH4NO3 + nn khí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là NỮ2
Câu 5. Dãy gồm các chất vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH là:
A. AlCl3Al2Ô3Al(OH)3
B. Al2Ô3Al(OH)3NaHCO3
C. Zn(OH)2Al2Ô3Na2khí CO3
D. ZnO, Zn(OH)2BÉ NHỎ4Cl
Al2Ô3 + 6HCl → 2AlCl3 + 3 gia đình2Ô
Al2Ô3+2NaOH→2NaAlO2 +ĐẦY ĐỦ2Ô
Al(OH)3 + 3HCl → AlCl3 + 3 GIỜ2Ô
Al(OH)3 + NaOH → NaAlO2 + 2 CĂN NHÀ2Ô
NaHCO3+ HCl → NaCl + CO2+ BẠN BÈ2Ô
NaHCO3+ NaOH → Na2khí CO3+ BẠN BÈ2Ô
Câu 6. Cho m gam bột Zn vào 500 ml dd Fe. giải pháp2(VÌ THẾ)4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng 9,6 gam so với dung dịch ban đầu. Giá trị của m là
A. 29,25.
B. 48,75.
C. 32,50.
D. 20,80.
NFe3+= 0,24 mol
Zn + 2Fe3+ → Zn2+ + 2Fe2+
0,12….0,24…………….0,24
Zn + Fe2+ → Zn2+ + Fe
x……………………x
→ mtăng đ = mZn– mFe= 65.(0,12 + x) – 56x = 9,6 → x = 0,2
=> nZn gốc = 0,12 + 0,2 = 0,23 mol
=> mZn = 0,32,65 = 20,8 gam
Câu 7. Làm các thí nghiệm sau:
(1) Cho Zn vào Fe . giải pháp2(VÌ THẾ)4)3 dư.
(2) Cho bột Mg vào lượng dư dung dịch HCl.
(3) Dây dẫn H2 dư qua ống sứ đựng Fe . bột2Ô3 đun nóng.
(4) Cho Ca vào lượng dư CuSO . giải pháp4.
(5) Cho dung dịch Fe(NO .)3)2 vào AgNO3. giải pháp3.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kim loại là
A. 4
B. 2
c.3
D.1
(2) Mg + 2HCl dư → MgCl2 + BẠN BÈ2 => không lấy được kim loại
(3) BẠN BÈ2dư + Fe2Ô3 → Fe + H2O => thu được kim loại Cu
(4) Ca + 2H2O → Ca(OH)2+ BẠN BÈ2
CuSO4+ Ca(OH)2 → Cu(OH)2 + CaSO4
=> không lấy được kim loại
(5) Fe(KHÔNG3)2 +AgNO3 → Fe(KHÔNG .)3)3 + Ag => được Ag . kim loại
Vậy có 2 thí nghiệm thu được kim loại sau phản ứng là (3) và (5)
Câu 8. Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 4,48 lít H . được yêu cầu2 (đktc). Nếu hòa tan hết hỗn hợp kim loại thu được bằng dung dịch HCl thì thể tích H2 (đktc) thu được là:
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Khi hòa tan hỗn hợp các kim loại có cùng hóa trị II trong một axit:
NH2 = nhh kim loại = 0,2 mol
VẼ TRANHH2 = 22.4.0.2 = 4,48 lít
Câu 9. Cho m gam hỗn hợp hai kim loại Fe, Zn phản ứng hoàn toàn với 200 ml dung dịch HCl 1,6M thoát ra 3,36 lít khí H (đktc).2. Dung dịch thu được có giá trị pH là (bỏ qua sự thủy phân của các muối).
A.2.
B.7.
C.4.
D.1.
NHCl dư = 0,2.1,6 – 0,3 = 0,02 mol
→ CŨM (dư HCl) = 0,02 : 0,2 = 0,1M → pH = 1.
Câu 10. Cho 500ml dung dịch NaOH 1M phản ứng với 200ml ZnSO. giải pháp4 1M, sau phản ứng thu được a gam kết tủa. giá trị của một là gì
A. 9,425.
B. 8,425.
C. 7,425.
mất 14.855
NZn2+ = nZnCl2 = 0,2.1 = 0,2 mol
Phương trình hóa học:
2NaOH + ZnSO4 → Zn(OH)2+ Nà2VÌ THẾ4 (Đầu tiên)
(0,5) (0,2) (0,2 mol)
0,1 mol NaOH dư, phản ứng tiếp tục xảy ra:
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
(0,1) (0,1 mol)
Sau phản ứng (1) và (2) n↓ = 0,2 – 0,05 = 0,15 mol
→ m↓ = a = 0,15,99 = 14,85 gam
Câu 11. Cho V lít dung dịch NaOH 2M vào 500ml dd ZnCl. giải pháp2 0,4M, sau phản ứng thu được 9,9 gam kết tủa. Giá trị của V là
A. 0,1 hoặc 0,3.
B. 0,1.
C. 0,05.
D. 0,05 và 0,15.
NZn2+ = nZnCl2 = 0,5. 0,4 = 0,2 mol
n↓ = 9,9/99 = 0,1 mol
phương trình hóa học
2NaOH + ZnCl2 → Zn(OH)2↓ + 2NaCl (1)
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
Ta có: n↓ = 0,1 Zn2+ → Có 2 trường hợp xảy ra
Trường hợp 1: NaOH hết; ZnCl2 dư
Theo (1) → nỒ– = 2n↓ = 0,2 mol
→ V = 0,2 : 2 = 0,1 lít
Trường hợp 2: NaOH và ZnCl2 hoàn toàn và kết tủa bị hòa tan một phần.
Theo (1) và (2) → nOH- = 4nZn2+ – 2n↓ = 0,6 mol
→ V = 0,6 : 2 = 0,3 lít
Vậy thể tích dung dịch NaOH 2M cần dùng là 0,1 lít hay 0,3 lít.
Câu 12. Cho một lượng bột Zn vào dung dịch X gồm FeCl2 và CuCl2. Khối lượng chất rắn sau khi phản ứng xảy ra hoàn toàn nhỏ hơn khối lượng bột Zn ban đầu là 0,5 gam. Làm bay hơi dung dịch sau phản ứng thu được 13,6 gam muối khan. Tổng khối lượng các muối trong X là
A.13,1 gam.
B.17,0 gam.
C.19,5 gam.
D.14,1 gam.
Đáp án A tôităng đ = mcon rắn rơi = 0,5 gam → mdd ban đầu = 13,6 – 0,5 = 13,1 gam
Câu 13. Cho 5,62 gam hỗn hợp gồm 3 Fe. oxit2Ô3MgO, ZnO tan vừa đủ trong 600ml H . giải pháp2VÌ THẾ4 0,1M thì khối lượng muối sunfat khan tạo thành là:
A. 5,33 gam
B. 5,21 gam
C. 10,42 gam
D. 5,68 gam.
Áp dụng phương pháp tăng cân:
tôimuối = moxit+ 0,06.( 96 – 16) = 5,62 + 0,06.80 = 10,42 gam
Câu 14. Oxi hóa hoàn toàn 30,2 gam hỗn hợp bột Cu, Zn, Al bằng oxi thu được 44,6 gam hỗn hợp các oxit. Hòa tan oxit này trong dung dịch HCl. Khối lượng muối khan thu được là:
A. 47,05
B. 63,90
C.94.10
D. 37,30
nO(oxit) = 0,9 mol => nCl-= 2.0,9 = 1,8 mol
tôimuối= mkim loại+ mCl-= 30,2 + 1,8.35,3 = 94,1 gam
Câu 15. Chất oxi hóa là chất
A. Cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa giảm dần sau phản ứng.
C. nhận electron, chứa các nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
TRẢ LỜI DỄ DÀNG
Câu 16. Cho các phản ứng oxi hóa – khử sau:
3tôi2 + 3 GIỜ2O → HIO3 + 5HI (1)
HgO → 2Hg + O2 (2)
4KCK2VÌ THẾ3 → 3K2VÌ THẾ4 + KỲ2S (3)
BÉ NHỎ4KHÔNG3 → PHỤ NỮ2O + 2H2Ô (4)
2KClO3 → 2KCl + 3O2 (5)
3KHÔNG2 + BẠN BÈ2O → 2HNO3 + KHÔNG (6)
4HClO4 → 2Cl2 + 7O2 + 2 CĂN NHÀ2Ô (7)
2 gia đình2Ô2 → 2 gia đình2Ô + Ô2 (số 8)
Cl2 + Ca(OH)2 → CaOCl2 + BẠN BÈ2Ô (9)
KMnO4 → KỲ2MnO4 + MnO2 + Ô2 (mười)
Trong số các phản ứng oxi hóa khử trên, số phản ứng oxi hóa khử nội phân tử là
A.2.
B.3.
C.4.
D.5.
TRẢ LỜI DỄ DÀNG